L'oxydation sélective de Baeyer-Villiger des cétones insaturées dépend certainement des conditions utilisées. Je ne veux pas éloborer davantage ce fait car il a été bien documenté dans la réponse de Waylander. Cependant, jusqu'à présent dans la littérature suggèrent que l'utilisation de peracides en présence d'insaturation dans la cétone substrat n'est pas une bonne idée. La citation «L'attaque du groupe carbonyle donne un réarrangement de Baeyer-Villiger conduisant d'abord aux énol lactones, puis par époxydation de ces dernières en époxy lactones» suggère clairement que l'oxydation de Baeyer-Villiger prédomine dans cette condition, mais l'époxydation suivante ne peut être évitée. Cependant, la littérature récente suggère que l'utilisation d'un catalyseur approprié peut arrêter la réaction lors de la formation du lactome, évitant l'époxydation à venir.
$ \ ce {Sn} $ La zéolite bêta dopée span> peut être utilisée pour arrêter les réactions secondaires après oxydation de Baeyer-Villiger (Réf.1 et Réf.2). L'utilisation d'acides solides tels que les zéolites comme catalyseur sélectif a permis d'éviter l'utilisation de peracides comme oxydant (l'oxydant traditionnellement utilisé) et de le remplacer par du peroxyde d'hydrogène moins cher et moins polluant ( $ \ ce {H2O2} $ ). Le problème majeur avec les conditions traditionnelles de l'oxydation de Baeyer-Villiger est leur manque de sélectivité suffisante pour le produit souhaité si la matière de départ contient des groupes fonctionnels autres que le groupe cétone. Cet inconvénient est bien comblé par l'utilisation de zéolithe bêta après incorporation de 1,6% en poids d'étain dans sa charpente comme catalyseur de choix (Réf.1). Cette zéolite bêta dopée $ \ ce {Sn} $ agit comme un catalyseur hétérogène efficace et stable pour l'oxydation de Baeyer-Villiger des cétones saturées et insaturées par $ \ ce {H2O2} $ , les lactones souhaitées ( par exemple , vinylester) formant plus de 98% des produits de réaction (Ref.1 ).
Lorsque $ \ ce {Sn} $ -Beta est utilisé comme catalyseur hétérogène pour la réaction de Baeyer – Villiger avec $ \ ce {H2O2} $ , les cétones cycliques sont transformées en lactones correspondantes, tandis que les cétones insaturées sont oxydées en lactones insaturées correspondantes avec une chimiosélectivité très élevée (Réf.2). Le catalyseur est également sélectif pour l'oxydation des aldéhydes aromatiques ( $ \ ce {Ar-CHO} $ ) avec $ \ ce {H2O2} $ , produisant l'ester formiate ( $ \ ce {HCOO-Ar} $ ) ou le produit hydrolysé correspondant, c'est-à-dire le phénol correspondant ( $ \ ce {Ar-OH} $ ). Des oxydations sélectives de forme sont observées pour des réactifs isomères de différentes formes moléculaires (Réf.2).
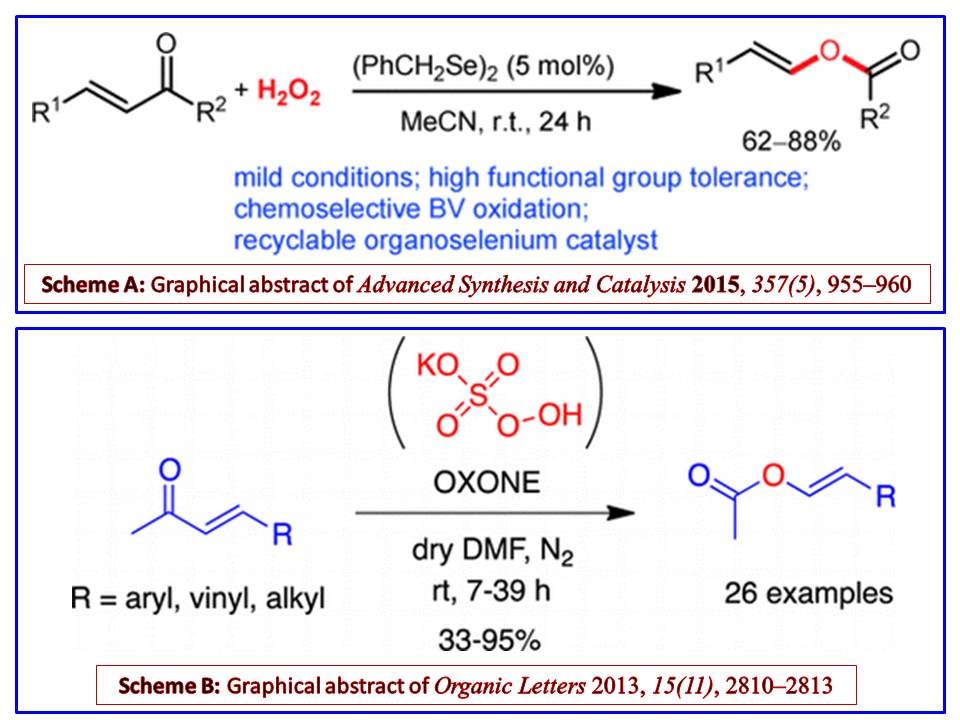
Apparemment, $ \ ce {H2O2} $ est le choix de l'oxydant pour éviter une oxydation supplémentaire de la double liaison. Zhang et coll. ont utilisé un catalyseur organosélénium avec $ \ ce {H2O2} $ pour effectuer une oxydation de Baeyer-Villiger sur $ \ alpha, \ beta $ -cétones insaturées (Ref.3), dont le résumé indique que:
En criblant soigneusement les pré-catalyseurs d'organosélénium et en optimisant les conditions de réaction, le simple diséléniure de dibenzyle s'est avéré être le meilleur pré-catalyseur pour l'oxydation de Baeyer – Villiger de ( E ) - $ \ alpha, \ beta $ -cétones insaturées avec le peroxyde d'hydrogène oxydant vert à température ambiante. Le catalyseur organosélénium utilisé dans cette réaction pourrait être recyclé et réutilisé plusieurs fois. Cette nouvelle méthode convient non seulement aux cétones à insaturation méthyle, mais également aux cétones à insaturation alkyle et aryle. Par conséquent, il a fourni un processus direct, doux, pratique et hautement fonctionnel pour la préparation chimiosélective des esters vinyliques polyvalents ( E ) à partir des ( E ) facilement disponibles. ) - $ \ alpha, \ beta $ -cétones insaturées. Un mécanisme possible a également été proposé pour rationaliser l'activité du catalyseur organosélénium en présence de peroxyde d'hydrogène dans cette réaction d'oxydation de Baeyer – Villiger.
En outre, la référence 4 décrit un Baeyer sans métal –Villiger synthèse d'acétates de vinyle en utilisant Oxone comme oxydant:
Oxone, un réactif oxydant bon marché, stable et non dangereux, transforme $ \ alpha, \ bêta $ -cétones insaturées de stéréochimie définie dans leurs acétates de vinyle correspondants par réaction de Baeyer – Villiger. Ce processus est général et simple, tolérant un large éventail de groupes fonctionnels.
Les deux résumés graphiques des Réf.3 et Réf.4 (Schéma A et Schéma B , respectivement) sont représentés dans le diagramme suivant pour votre commodité:
Notez que l'Oxone (peroxomonosulfate de potassium) a été utilisé dans l'époxydation d'alcènes dans des conditions diphasiques en présence d'une cétone (généralement de l'acétone) et d'un catalyseur de transfert de phase ( par exemple , Réf.5 et Réf.6 ). Cependant, dans ces conditions, l'époxydation a échoué lorsque l'alcène du substrat est une cétone insaturée $ \ alpha, \ beta $ (Ref.5).
Références:
- A. Corma, LT Nemeth, M. Renz, S. Valencia, " $ \ ce {Sn} $ -zéolite bêta comme catalyseur chimiosélectif hétérogène pour les oxydations de Baeyer-Villiger," Nature 2001 , 412 , 423–425 ( https://doi.org/10.1038/35086546).
- Michael Renz, Teresa Blasco, Avelino Corma, Vicente Fornés, Robert Jensen, Laszlo Nemeth, «Oxydations sélectives et sélectives de forme de Baeyer-Villiger d'aldéhydes aromatiques et de cétones cycliques avec $ \ ce {Sn} $ -beta Zeolites et $ \ ce {H2O2} $ ," Chemistry - A European Journal 2002 , 8 (20) , 4708-4717 ( https://doi.org/10.1002/1521-3765 (20021018) 8:20<4708::AID-CHEM4708>3.0.CO;2-U).
- Xu Zhang, Jianqing Ye, Lei Yu, Xinkang Shi, Ming Zhang, Qing Xu, Mark Lautens, «Organoselenium- Oxydation de Baeyer – Villiger catalysée de $ \ alpha, \ beta $ - Ke non saturé tones by Hydrogen Peroxide to Access Vinyl Esters », Advanced Synthesis and Catalysis 2015, 357 (5), 955–960 ( https://doi.org/10.1002/adsc.201400957).
- Belén Poladura, Ángel Martínez-Castañeda, Humberto Rodríguez-Solla, Ricardo Llavona, Carmen Concellón, Vicente del Amo, «Synthèse générale sans métaux de type Baeyer – Villiger d'acétates de vinyle», Org. Lett. 2013 , 15 (11) , 2810-2813 ( https://doi.org/10.1021/ol401143q) .
- Norio Hashimoto, Atsushi Kanda, «Époxydation pratique et respectueuse de l'environnement des oléfines à l'aide d'Oxone», Org. Proc. Res. Dev. 2002 , 6 (4) , 405–406 ( https://doi.org/10.1021/op025511f) .
- Scott E. Danemark, David C. Forbes, David S. Hays, Jeffrey S. DePue, Richard G. Wilde, «Catalytic Epoxidation of Alkenes with Oxone», J. Org. Chem. 1995 , 60 (5) , 1391-1407 ( https://doi.org/10.1021/jo00110a049) .