Regardez attentivement, c'est tétraédrique (déformé) - quatre groupes à des positions presque symétriquement dans l'espace 3D {*}. L'hybridation est donc $ sp ^ 3 $.
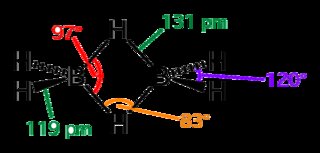
Comme vous pouvez le voir, la forme est déformée, mais elle est tétraédrique. Techniquement, on peut dire que les liaisons banane sont constituées d'orbitales similaires à $ sp ^ 3 $ mais pas exactement (comme deux orbitales $ sp ^ {3.1} $ et deux orbitales $ sp ^ {2.9} $ - car l'hybridation est juste addition de fonctions d'onde, on peut toujours changer les coefficients pour donner une géométrie correcte). Je n'en suis pas trop sûr cependant.
$ \ ce {B} $ a un shell de valence $ 2s ^ 22p ^ 1 $, donc trois liaisons covalentes lui donnent un octet incomplet. $ \ ce {BH3} $ a une orbitale $ 2p $ vide. Cette orbitale chevauche le nuage de liaisons $ \ ce {BH} $ $ \ sigma $ existant (dans un $ \ ce {BH3} $ à proximité) et forme une liaison 3c2e.
Il semble que il y a beaucoup plus de composés avec une géométrie 3c2e. J'avais complètement oublié qu'il y avait des séries homologues entières 'sous' boranes 'qui ont toutes des liaisons 3c2e (mais pas la même structure)
Et il y a des composés d'indium et de gallium comme bien. Toujours groupe IIIA, bien que ce soient des métaux. Je suppose qu'ils, comme $ \ ce {Al} $, forment toujours des liaisons covalentes.
Donc, la raison fondamentale pour laquelle cela se produit est due à un octet incomplet qui veut se remplir.
Notez que "banane" n'est pas nécessairement uniquement pour les obligations 3c2e. Toute liaison pliée est appelée une liaison "banane".
Concernant les structures similaires, $ \ ce {BeCl2} $ et $ \ ce {AlCl3} $ viennent à l'esprit, mais les deux d'entre eux ont la structure via des liaisons datives (coordonnées). De plus, $ \ ce {BeCl2} $ est planaire.
Se faufile et vérifie Wikipédia. Wikipédia dit que $ \ ce {Al2 (CH3) 6} $ est similaire dans sa structure et son type de lien.
Je suppose que nous avons moins de tels composés car il y a relativement peu d'éléments ($ \ ce {B} $ group à peu près) avec des électrons de valence $ \ leq3 $ qui forment des liaisons covalentes (critères pour l'orbitale vide). De plus, $ \ ce {Al} $ est un cas incertain - il ressemble à la fois aux liaisons covalentes et ioniques. Aussi, pour cette géométrie (soit par des liaisons banane, soit par des liaisons datives), je suppose que les tailles relatives comptent également - puisque $ \ ce {BCl3} $ est un monomère même si $ \ ce {Cl} $ a une paire isolée et peut former une liaison dative.
* Peut-être êtes-vous habitué à la vue de la structure tétraédrique avec un atome en haut? Inclinez mentalement l'atome de bore jusqu'à ce qu'un hydrogène soit en haut. Vous devez comprendre que c'est également tétraédrique.