La taupe est une mesure de nombre . Le concept "Mole" nous aide à peser ou à compter des nombres définis d'atomes (à l'exclusion des erreurs infimes) simplement en utilisant une balance pan-macroscopique. Si je sais que c'est du glucose, et en prendre 180 grammes (puisque C6 H12 O6 a un poids moléculaire de 180); l'échantillon contient 1 mole ou des nombres avogadro (N.A) ou 6,023 * 10 ^ 23 molécules de glucose. De même, 18 grammes H2O doit contenir 1 mole ou 6,023 * (10 ^ 23) molécules d'eau.
Mais comment?
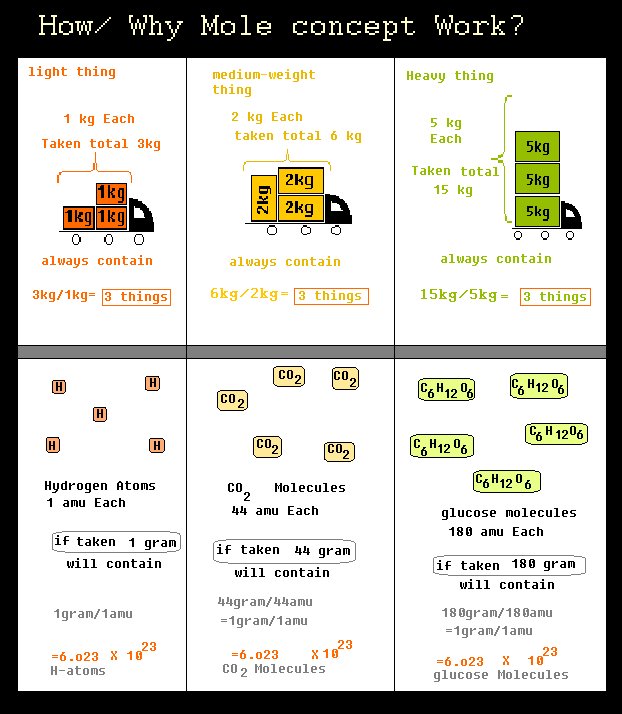
Commençons par quelques objets macroscopiques .
Si nous prenons 1 camion plein de briques et un autre camion plein de briques; le deuxième camion contiendrait beaucoup plus de copeaux de brique que de briques dans le premier. Simple.
Mais si on prenait 1 brique de camion (masse totale de brique très lourde); et 1 seau de briques-copeaux (masse totale de briques-copeaux beaucoup plus légère que les briques de camion) ... alors? Peut-être que les deux contiendront le même nombre (au moins presque) de particules.
I.e. si nous prenons des objets lourds en quantité massive et des objets légers en quantité plus légère; le nombre d'objets des deux cas, aurait tendance à être le même.
En termes quantitatifs:
Dites chaque brique-puce = 1 gramme. 1 brique = 1000 grammes.
Maintenant, si nous prenons 1234 * 1 gramme de morceaux de brique et 1234 * 1000 grammes de briques; nous aurons le même nombre de particules unitaires dans les deux cas.
Ou si nous prenons X * 1 gramme de briques à un endroit, et X * 1000 grammes de briques à un autre endroit; dans les deux cas, nous aurions le même nombre.
Échelle moléculaire
1 atome d'hydrogène (H) pèse 1 h du matin. 1 molécule de glucose (C6 H12 O6) pèse 180 um. 1 molécule de H20 pèse 180 heures du matin.
Maintenant, 1 gramme = 6,023 * (10 ^ 23) Dalton ou N.A a.m.u. (*)
Donc, tout comme notre exemple de brique mentionné ci-dessus;
1 gramme d'atome d'hydrogène (H) (ou NA amu H), ou 180 grammes de glucose (c'est-à-dire NA * 180 amu de glucose) ou 18 grammes d'eau (NA * 18 amu d'eau) contiendrait le même nombre de particules ( Ce qui est ici 6.023 * (10 ^ 23) pièces ou pièces NA en raison de la relation entre gramme et amu). De cette façon, 1 mole de n'importe quelle substance contiendrait un nombre NA de molécules
Nombre Avogadro (N.A.) dans cet exemple fonctionnant de la même manière que X dans l'exemple de brique précédent.
Voici un schéma simplifié comparant un exemple réel et un exemple de chimie.
Avantage
On nous donne
1 C6 H12 O6 + 6 O2 = 6 CO2 + 6 H2O
Les nombres à gauche de la formule du composé , ou le coefficient stoechiométrique; est le plus petit nombre possible de molécules pour terminer une réaction.
On nous donne une certaine quantité de glucose, et on nous demande la quantité de CO2 dégagée après une combustion complète en O2?
Nous pouvons calculer cela fraîchement à partir du matin. Calcul plus grand.
Mais le concept de mole aide beaucoup car nous pouvons déterminer les quantités de réactifs et de produits directement en gramme, à partir de la formule moléculaire et des coefficients stœchiométriques, sans utiliser de conversion d'unité entre gramme et amu
Si nous pouvions multiplier toute la réaction
(180 amu + 6 * 32 amu = 6 * 44 amu + 6 * 18 amu pour le composé respectif)
avec NA (peut exécuter des nombres NA de telles réactions à la fois)
i. e.
180 amu * NA + 6 * 32 amu * NA = 6 * 44 amu * NA + 6 * 18 amu * NA (composé respectif)
ou
1 mole de glucose + 6 mole d'O2 = 6 mole de CO2 + 6 mole de H2O.
ou
180 gramme + 6 * 32 gramme = 6 * 44 gramme + 6 * 18 gramme (composé respectif).
une fois que nous avons su le fait à la place de la molécule, nous pourrions utiliser mole; et nous pourrions facilement écrire une réaction pour une mole des réactions parallèles. Ensuite, nous convertissons les moles en grammes en utilisant la formule chimique, nous pouvons facilement déterminer la quantité requise ou obtenue de certains réactifs ou produits. Pour une certaine valeur donnée de 1 réactif ou produit
par exemple 2 H2 + O2 = 2 H2O. De cette réaction, nous concluons facilement 2 mole de H et 1 mole d'O2 forme 2 moles de H2O; ou 2 * 2 g H2 et 32 g O2 donnent 2 * 18 g H20. Maintenant, en utilisant la méthode unitaire, nous pourrions trouver une quantité demandée de réactif ou de produit à partir d'une quantité donnée de réactif ou de produit.
références:
-
(* ): http://chemistry.bd.psu.edu/jircitano/mole.html
-
Résultat de conversion d'unité Google
-
Constante d'Avogadro dans wikipedia
-
Unité de masse atomique dans Wikipedia
-
Taupe (unité) dans Wikipédia
-
Masse atomique dans wikipedia
-
Masse moléculaire dans wikipedia
-
Masse molaire dans Wikipédia
-
Ce que nous avons appris dans les cours de chimie de base