Si ce composé peut subir une substitution nucléophile, ce ne peut être que via S N 1 mode , comme l'attaque inverse dans l'anti-bonding $ \ ce {C -Br} $ orbitale est bloquée par l'autre tête de pont.
La raison souvent donnée pour laquelle les cations de carbone de la tête de pont ne sont pas stables est la déformation. La contrainte elle-même est un concept difficile à appréhender et dépend le plus souvent de ce que vous choisissez comme système de référence. Dans un seul but qualitatif, le cation est plus contraint qu'un cation tertiaire non contraint.
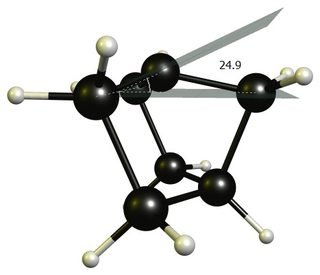
Une autre raison souvent invoquée est que le carbocation ne peut pas adopter une structure plane trigonale. Bien que cela soit techniquement vrai, l'écart par rapport à un environnement trigonal idéal est assez faible; c'est à peu près 25 °. (DF-BP86 / def2-SVP)
Je pense que la raison de cette instabilité est un peu différente. Dans $ \ ce {C + (CH3) 3} $, les liaisons hydrogène-carbone peuvent s'aligner parfaitement avec l'orbitale p vide du carbone central. Par conséquent, la densité électronique peut être transférée dans cette orbitale ou d'un autre point de vue, la charge positive peut être délocalisée dans les liaisons voisines.
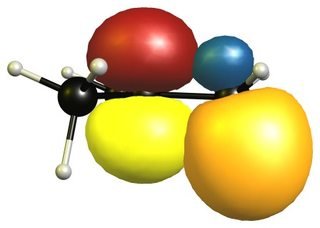
Ce qui précède est juste un exemple de configuration calculé à DF-BP86 / def2-SVP. Ce n'est pas la structure la plus basse, mais celle choisie pour montrer le chevauchement dans l'hyperconjugaison. Comme la molécule n'est pas du tout rigide et que les groupes méthyle tournent, l'effet stabilisant sera la plupart du temps, dans cette conformation il est plus facile à voir.
Cet effet stabilisant n'est pas présent pour le carbone liaisons hydrogène à proximité de la tête de pont. Ces hydrogènes pointent en fait loin du centre cationique, donc le chevauchement n'est pas du tout possible. Par conséquent, la charge ne peut pas être stabilisée par ces obligations.
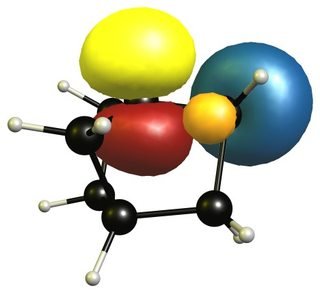
Cependant, il existe une petite configuration de stabilisation entre les liaisons carbone-carbone et l'orbitale inoccupée et c'est la raison pour laquelle les carbocations de la tête de pont deviennent plus stabilisés avec une structure cyclique plus grande.
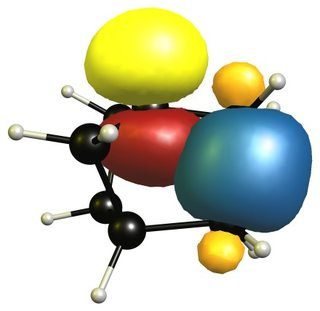
Comme toujours, il y a deux ou trois points différents en jeu, qui aident à stabiliser certaines positions, ou cessent de le faire.
Donc, avec la bonne motivation, un S N sub > 1 réaction pourrait être possible.
Colourcode
Les orbitales occupées sont affichées en orange et bleu, tandis que les orbitales virtuelles sont affichées en rouge et jaune. Les phases sont choisies au hasard.