Je vais faire valoir que la distance entre les molécules augmente généralement avec la température pour des raisons très fondamentales, bien que la glace normale (I h ) et l'eau liquide soient une exception. À basse température, les substances minimisent leur énergie, ce qui se traduit généralement par des arrangements cristallins ordonnés. À des températures élevées, les substances maximisent leur entropie. Autrement dit, à des températures élevées, tout est aussi aléatoire et mélangé que possible.
En supposant que vous ayez un espace vide, il y a plus de façons de mettre deux molécules loin l'une de l'autre que de rapprocher deux moleucules . Vous pouvez le voir dans le diagramme ci-dessous. Il y a plus de façons de placer une deuxième molécule dans la coquille sphérique bleue, à une grande distance de la molécule d'eau centrale, que de placer des molécules d'eau dans la coquille sphérique orange, à une courte distance de la molécule d'eau centrale. En fait, le nombre de façons de placer la deuxième molécule d'eau augmente avec le volume de la coquille sphérique, soit 4πR 2 , où R est la distance entre les molécules. Ainsi, l'état où deux molécules d'eau ont une longue distance entre elles a une entropie plus grande que l'état où elles ont une courte distance entre elles.
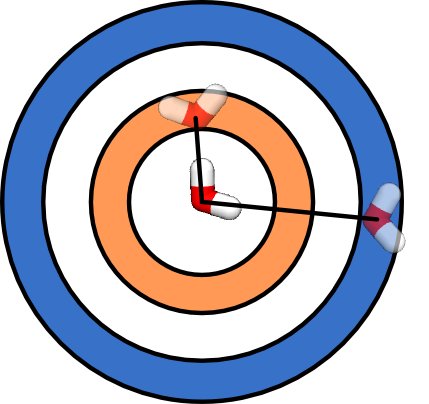
Simplement à cause de la géométrie, à des températures élevées, les molécules auront tendance à être très éloignées. L'eau bout à haute température simplement parce qu'il y a plus de façons de disperser les molécules d'eau dans toute la cuisine que de placer toutes les molécules d'eau dans le pot. La plupart des substances deviennent des gaz à des températures suffisamment élevées pour un espace vide suffisant. La plupart des substances se dilatent à mesure que leur température augmente.
Ajouter de la distance entre les molécules n'est pas le seul moyen d'augmenter l'entropie, ce qui représente l'exception de la fonte des glaces. L'entropie peut également augmenter en rendant l'arrangement des molécules et leurs orientations plus désordonnés. L'eau liquide a plus d'entropie que la glace non pas parce que les molécules sont plus éloignées, mais parce qu'elles se sont arrangées et orientées plus au hasard.