Elucider la structure orbitale atomique d'un atome est une histoire fascinante. Il vient d'être résolu au cours des cent dernières années. Ce n'était pas un voyage linéaire, mais un voyage rempli de toutes sortes d'impasses et de voyages secondaires. Les Grecs pensaient que les éléments étaient l'air, le feu, l'eau et la terre. Ne comprenant pas les atomes, les alchimistes ont passé des milliards d'heures et une quantité incalculable d'argent à essayer de transformer d'autres substances en or.
Ainsi, la première étape significative dans la résolution de la structure atomique commence avec Dmitri Mendeleev qui est crédité de la notion de tableau périodique. Cela a permis de découvrir des éléments supplémentaires qui étaient nécessaires pour compléter le tableau. Cependant, la raison pour laquelle la disposition de la table fonctionnait était inconnue.
À peu près à la même époque, d'autres travaux se déroulaient. Maxwell a créé ses célèbres équations liant le courant électrique et le magnétisme.
La découverte de l'électron s'est produite à peu près au même moment. Mais ce n'est que vers 1900 que la compréhension d'un électron fut assez complète.
Les physiciens ne comprenaient toujours pas comment assembler un atome. À ce stade, de nombreux modèles atomiques ont été lancés pour expliquer divers phénomènes. Un de ces modèles était le modèle de pudding à plomb. L'idée était qu'un atome était comme une goutte de pudding dans laquelle les électrons étaient suspendus comme des prunes dans le pudding.
Une grande avancée est venue de la diffusion de Rutherford vers 1910. Ces expériences ont montré que le noyau (charge positive) était situé au centre d'un atome et qu'il avait un très petit volume par rapport à l'atome entier. Cela a conduit au modèle planétaire de l'atome. Les électrons chargés négativement ont tourné autour du noyau chargé positivement comme les planètes en orbite autour du soleil.

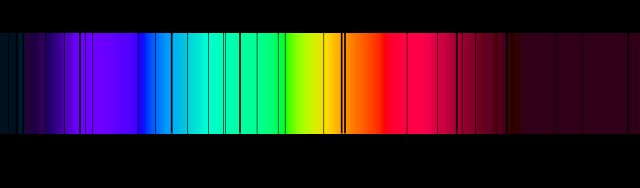
Cela n'expliquait pas d'autres phénomènes connus comme les spectres de raies d'hydrogène que Balmer avait découverts avant 1900.

De tels spectres de raies étaient liés via la formule de Rydberg qui liait le nombre quantique principal $ n $ à la structure atomique.
$ \ frac {1} {\ lambda} = R (\ frac {1} {{n_1} ^ 2} - \ frac {1} {{n_2} ^ 2}) $
en 1913, le modèle Bohr a été développé. Cela expliquait que les électrons étaient disposés en coquilles et que le remplissage de la structure de la coquille pouvait être lié au tableau périodique!
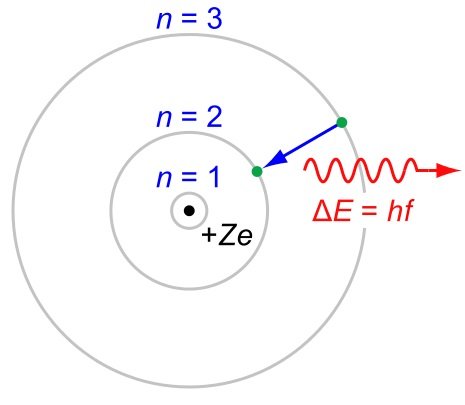
La structure de la coque est fondamentalement fixée sur le modèle planétaire par Arnold Sommerfeld et l'idée était que pour une raison quelconque, les électrons ne pouvaient pas tournent autour du noyau de l'atome dans "n'importe quelle" orbite mais qu'ils devaient occuper certaines orbites qui devinrent connues sous le nom de coquilles. Des sous-couches ($ l $, $ m $ et $ s $) ont été ajoutées au modèle de Bohr pour truquer des orbites supplémentaires afin d'expliquer la structure spectroscopique fine de certains éléments. Comme les raies de Fraunhofer observées dans les spectres du soleil.
Donc, à ce stade, les physiciens et les chimistes avaient catalogué une grande partie du comportement des atomes, mais n'avaient toujours pas une compréhension complète de la façon dont les atomes travaillé.
Au milieu des années 1920, Schrödinger a développé sa célèbre équation qui a complété le puzzle de la structure des atomes en électrons et noyaux plus fondamentaux. À partir du modèle de Bohr, il a été réalisé que les électrons doivent être sur certaines orbites car les orbites sont quantifiées. C'est-à-dire que chaque orbitale a une énergie spécifique. Ce que Schrödinger a montré, c'est que les orbites n'étaient pas comme les voies d'un événement d'athlétisme qui contraignait les électrons, mais que l'orbite des électrons était distribuée dans un nuage 3D autour de l'atome. Un autre aspect du travail de Schrödinger et d'autres était que l'électron avait à la fois des caractéristiques d'onde et des caractéristiques de particule.
En utilisant l'équation d'onde de Schrödinger, la forme des orbitales peut être calculée. Maintenant, c'était dans les années 1930, les ordinateurs étaient encore à des décennies. Donc ces calculs ont été faits à la main! Le "problème" était que la résolution des équations n'était possible que pour un électron. En utilisant le calcul, il est agréable de pouvoir résoudre des équations afin que les intégrales puissent être facilement calculées. Cependant, le problème des trois corps ne permet pas une telle solution. Avec les ordinateurs modernes, il est possible de calculer des solutions numériques même si les intégrales n'existent pas.
Revenons donc à la question. Une orbitale est une fonction mathématique qui décrit le chemin 3D d'un électron autour du noyau. Plutôt qu'une "orbite" planétaire, l'orbitale est une fonction de probabilité. La densité de l'orbite varie en fonction du rayon. En fonction de l'orbite, la fonction de probabilité montre également une orientation dans l'espace 3D. Ainsi, une orbitale S est sphérique en ce sens qu'il n'y a pas de préférence X-Y-Z. les orbitales P ont non seulement un aspect radial mais elles ont des orientations spatiales. Ainsi, les trois orbitales P sont comme des rotations 3D d'une rose à deux feuilles dans l'espace 2D. Les orbitales P ont donc des lobes orientés le long de l'axe +/- x, l'axe +/- y et l'axe +/- z.
Un mot d'avertissement. Les représentations orbitales sont très utiles pour prédire le comportement chimique, mais elles ne sont pas «réelles». Cela devient évidemment un peu fou lorsque quatre orbitales moléculaires $ sp ^ 3 $ sont formées chacune avec 25% de caractère S et 75% de caractère P! C'est un peu comme penser qu'une licorne est un hybride d'un cheval et d'un rhinocéros.