L'azote est dans la deuxième ligne sans orbitale $ d $ dans la coquille de valence. Il obéit à la règle de l'octet et ne peut pas avoir plus de 8 électrons.
Il existe des exceptions à la règle des octets. Avoir moins de 8 électrons est moins préférable mais toujours possible, et est couramment observé dans les radicaux libres et les cations. D'un autre côté, avoir plus de 8 électrons est extrêmement défavorable pour les atomes de seconde période. De telles structures électroniques peuvent être trouvées dans des espèces extrêmement instables ou des états excités, tels que le radical CH5.
À titre de comparaison, les premiers atomes de coquille obéissent à la règle du duo tandis que les atomes de la troisième coquille et au-delà peuvent obéir 18- règle des électrons, règle des 12 électrons ou règle des 8 électrons. Cependant, la règle des 18 électrons et les règles des 12 électrons sont beaucoup moins strictes que la règle des 8 électrons et les violations sont monnaie courante.
Selon la théorie des liaisons de valence, la structure électronique de une molécule est une combinaison de toutes les structures de résonance possibles que vous pouvez noter, y compris des structures avec toutes les charges formelles possibles et des comptages d'électrons étranges. Cependant, leurs contributions ne sont pas égales. certains d'entre eux sont plus favorables que d'autres.
Pour HNO3, afin de satisfaire la règle de l'octet, l'atome d'azote formerait 1 double liaison et 2 simples liaisons. En se basant uniquement sur la règle de l'octet, il existe 3 structures de résonance possibles qui sont favorables.
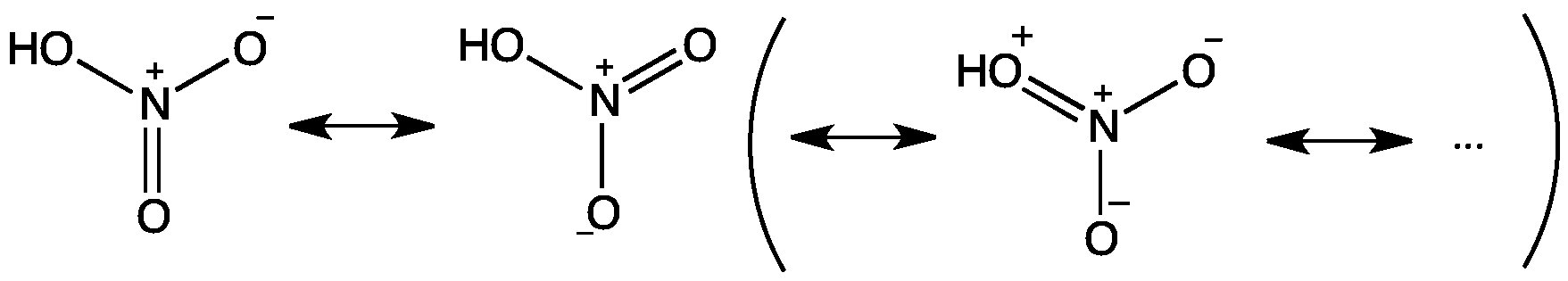
Cependant, les deux premières structures de résonance sont nettement plus favorables que la troisième, car elles avoir une plus petite quantité de frais formels. En conséquence, nous n'écrivons généralement que les deux structures dominantes. La liaison entre OH et N est proche d'une simple liaison normale. Les deux autres liaisons NO ont un ordre de liaison proche de 1,5.
Il est également courant d'écrire un mélange de structures de résonance sous la forme forme hybride
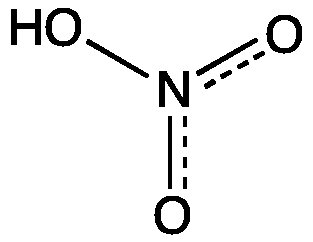
Notez que cette représentation n'est pas une structure de Lewis unique , mais un moyen pratique de représenter de nombreuses structures de résonance dans la même figure. Il ne donne aucune information sur l'ordre exact des liaisons ou les charges formelles sur les atomes individuels. Les lignes pointillées indiquent que dans certaines structures où cette liaison est une liaison simple et dans d'autres une double liaison, et l'ordre se situe quelque part entre 1 et 2.