Il y a déjà suffisamment de réponses à votre question. mais je veux aussi partager mon opinion;). Pré-note: Orbital ne signifie pas électron, ce que vous pouvez visualiser est juste où il sera susceptible de se trouver, ce qui est fondamentalement un orbitale.
Tout d'abord, vous ne pouvez pas visualiser une orbitale car elle a 3 variables indépendantes (uniquement dans le cas de l'hydrogène comme l'atome. pour les autres atomes ayant 2 électrons ou plus, il est supérieur à 3), pour visualisez-le vous avez besoin d'une vision 4-D , ce qui n'est certainement pas possible . Mais vous pouvez visualiser une partie de sa fraction, comme 99% en utilisant des nuances. Là où il est le plus susceptible de se trouver, vous pouvez le rendre plus sombre ou là où il ne sera probablement pas trouvé, laissez-le blanc

1s Orbital
 Orbital 2s
Orbital 2s
 Orbital 2p
Orbital 2p
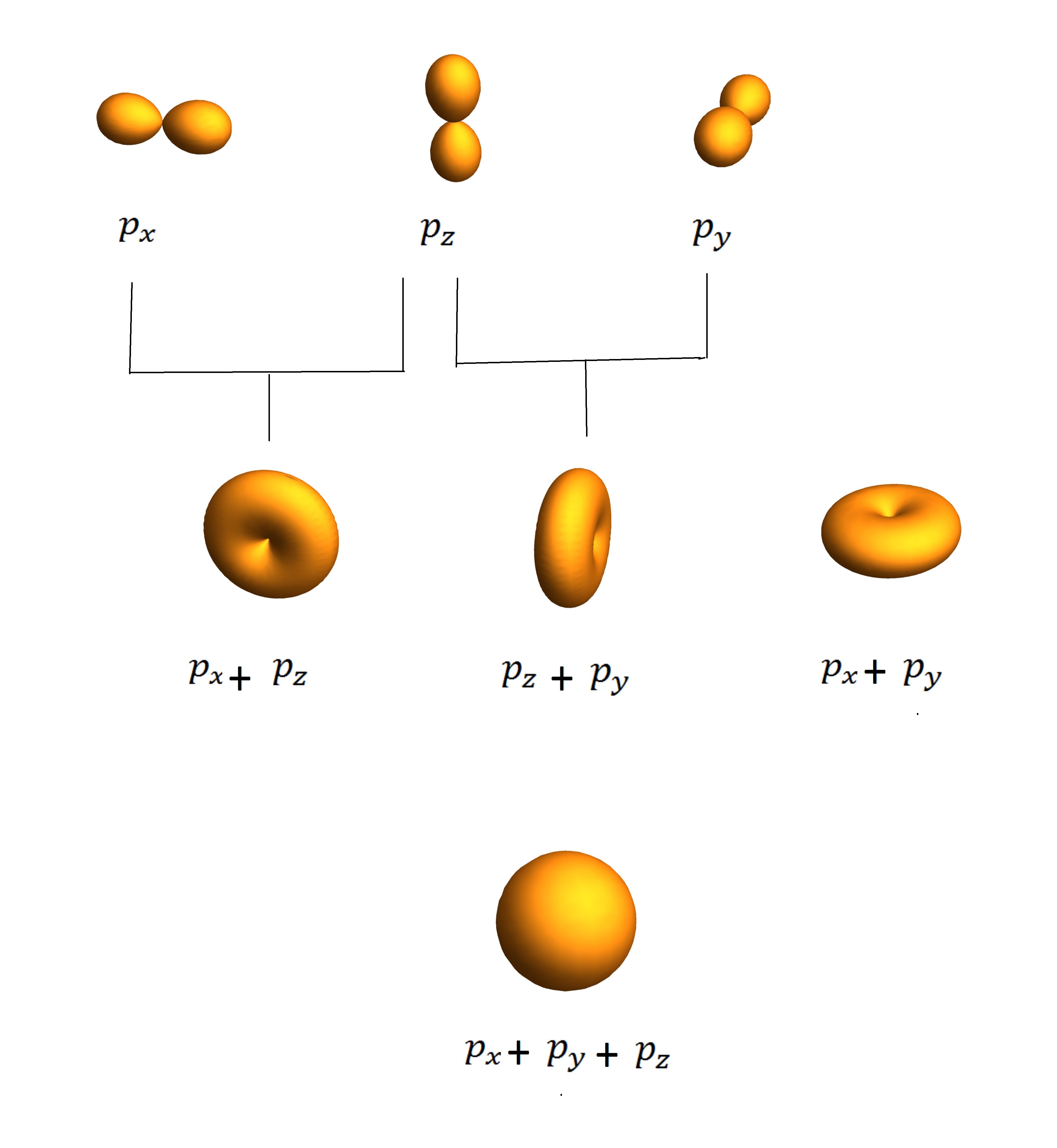
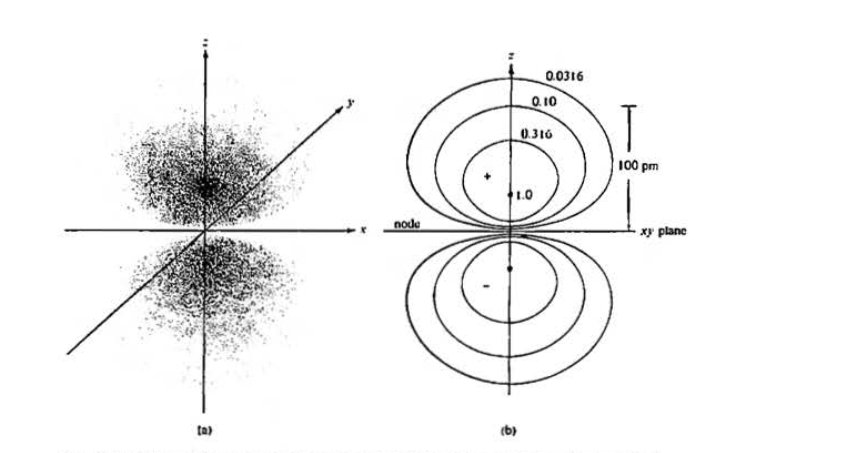
Il existe un autre moyen mais cela n'a pas l'air sympa, la façon dont nous enfermons quelques volumes consécutifs pour décrire la densité de probabilité de trouver un électron dans le volume respectif (Quelque chose comme des couches) (L'image de droite est le graphique de contour , celle de gauche est comme ci-dessus).
Si vous vous déplacez sur n'importe quelle ligne, vous vous retrouverez dans une zone où la densité de probabilité est la même. Celles-ci sont appelées isosurfaces . Ceux-ci peuvent être très fantaisistes, agréables à visualiser. Voici quelques surfaces limites Iso de certaines orbitales. Attention: aucune de ces images ne montre des images d'orbitales, ce ne sont que des surfaces limites. (Dans de nombreux livres, ces images font référence à des images orbitales sans aucune précision qui peut être trompeuse)